| ■ Hello
School 中学理科(ハロ理科) No.7 水溶液の性質 ■ |
| インターネット上で中学校の理科が勉強できるよ♪ |
| ノートに理解しながら写して、一通り終えたら練習問題で実力を定着させていこうね♪ |
|
| 1.水溶液の性質 |
| (1)水溶液 |
溶液…ある液体に他の物質が溶けている状態のもの。
・透明である。(色がついていても、透き通っているものも含める)
・放置しても溶けている物質が出てこない。
・どの部分も同じ濃さである。
溶質…溶液中に溶けている固体・液体・気体。
溶媒…溶質を溶かしている液体。 |
|
|
| |
| (2)固体の水への溶け方 |
水の中に固体を入れると、かき混ぜなくても、少しずつ溶けていく。
長時間放置しておくと、固体が一様に広がり、水溶液全体が均質になる。 |
|
| いろいろな水溶液 |
|
| 固体 |
|
水溶液 |
|
|
|
| 氷砂糖 |
→ |
無色透明の水溶液 |
| 硫酸銅 |
→ |
青色透明の水溶液 |
| 過マンガン酸カリウム |
→ |
赤紫色透明の水溶液 |
| 水酸化カルシウム |
→ |
全体が白くにごる
→ろ過すると、無色透明のろ液(ろ液が水溶液) |
| | |
|
| 2.溶解度と再結晶 |
| (1)水に溶ける量と温度 |
水の中に
少量の食塩を入れかき混ぜる→全部溶ける。
多量の食塩を入れかき混ぜる→全部溶けず、溶け残る。
温度を上げると、
ミョウバン・ホウ酸などはすぐに溶けていくが、食塩はあまり変化しない。 |
| ↓ |
一定の水の中に物質の溶ける量は決まっていて、水の温度で変化し、
その変化は物質の種類によって違う。 |
| |
|
| (2)溶解度と再結晶 |
飽和水溶液…物質は水にいくらでも溶けるのではなく、
決まった量までしか溶けない。
もうそれ以上溶けない状態を飽和状態
といい、その水溶液のこと。
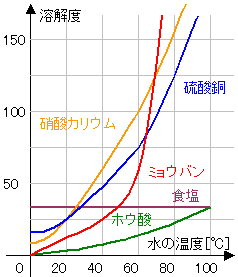
溶解度…ある温度で、100gの水に溶けることができる
物質の最大量。
いろいろな物質の溶解度と水の温度の関係を
表したものが右の図である。(溶解度曲線)
結晶…飽和水溶液を冷やしたり水を蒸発させて得られた
もとの固体の粒。
・平面で囲まれた規則正しい形で純粋な物質。
・形や色は物質によって異なる。
再結晶…固体が溶けている水溶液から、もとの固体が
再び結晶として取り出されること。 |
 |
再結晶の方法
①飽和水溶液を冷やす →ミョウバン・硫酸銅・ホウ酸など。
②飽和水溶液から水を蒸発させる→食塩
再結晶は不純物を取り除くことができ、これを精製という。 | |
|
| 3.濃度 |
| (1)水溶液の質量 |
水溶液の質量は
溶媒の質量と溶液の質量の和
になる。
溶け残りができた場合も、
この関係は変わらない。 |
| 食塩10g |
|
水90g |
|
食塩水100g |
 |
+ |
 |
= |
 |
| 溶質の質量 |
+ |
溶媒の質量 |
= |
溶液の質量 | |
| |
|
| (2)濃度 |
| 濃度…水溶液全体の質量に対する溶質の質量の割合。下の公式によって求める。 |
|
|
| または |
| 濃度[%]= |
| 溶質の質量[g] |
|
| 水の質量[g]+溶質の質量[g] | |
×100 | | |
|
| 4.酸性とアルカリ性 |
| (1)酸性 |
酸性の水溶液の特徴
・青色リトマス紙に水溶液をつけると、赤色に変化する。
・水溶液にBTB液を加えると、黄色になる。
・金属を溶かして、水素を発生する。
・すっぱい味がする。
水溶液が酸性を示す物質のことを酸という。 |
酸性のBTB液の反応
 |
| |
酸性のリトマス紙の反応
| |
| |
| (2)主な酸の性質 |
①塩酸
・気体が塩化水素の無色の水溶液。
・刺激臭がある。
・金属(アルミニウム・マグネシウム・亜鉛・鉄など)を溶かして水素を発生する。
・濃い塩酸をアンモニア水に近づけると、白煙(塩化アンモニウム)が立ち上る。
(塩酸から蒸発した塩化水素とアンモニア水から蒸発したアンモニアが結びついてできた)
②硫酸
・無色無臭の水溶液だが、ねばりけのある液体。
・水よりかなり重い。水と混ぜると激しく発熱する。
・希硫酸(うすい塩酸)は金属と反応して水素を発生する。
・濃硫酸は金属と反応しない。
③酢酸
・無色透明の水溶液だが、刺激臭がある。
・濃い酢酸は寒いときは凍って固体になるので、氷酢酸と呼ばれる。
・食酢は酢酸が3~5%を含まれたものである。
④炭酸
・二酸化炭素が水に溶けてできたもの。
・水溶液としてだけ存在する。 |
| |
| (3)アルカリ性 |
アルカリ性の水溶液の特徴
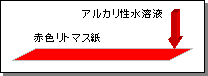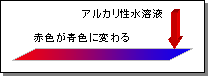
・赤色リトマス紙に水溶液をつけると、青色に変化する。
・水溶液にBTB液を加えると、青色になる。
・水溶液にフェノールフタレイン液を加えると赤色になる。
・にがい味がする。
・手でこするとぬるぬるする。
水溶液がアルカリ性を示す物質のことをアルカリという。 |
アルカリ性の
BTB液の反応
 |
| |
アルカリ性のリトマス紙の反応
 | |
| |
| (4)主なアルカリの性質 |
①水酸化ナトリウム
・白色半透明の固体で水によく溶ける。
・空気中に放置しておくと、空気中の水分を吸収して溶ける(潮解という)
・二酸化炭素を吸収する
・たんぱく質や脂肪を分解する。
②水酸化カルシウム
・白色の固体で消石灰とも呼ぶ。
・水に溶けにくく、溶けた水溶液を石灰水という。
・二酸化炭素の検出に使われる。
③水酸化バリウム
・白色の固体で水に溶ける。
・硫酸イオンの検出に使われる。
④水酸化カリウム
・無色の固体で水によく溶ける。
・二酸化炭素の吸収剤として使われる。
⑤アンモニア水
・特有の刺激臭をもつ。
・虫さされの薬として使われる。 | |
|
| 5.中和と塩 |
| (1)中和 |
中和…酸性の水溶液とアルカリ性の水溶液を混ぜて、それぞれの性質を打ち消しあい、
水と塩ができること。 |
| |
| (2)主な塩 |
①塩化ナトリウム
・塩酸と水酸化ナトリウムとの中和によってできる無色の塩。立方体の結晶。
②硫酸バリウム
・硫酸と水酸化バリウムとの中和によってできる白色の塩。同時に白い沈殿もできる。
③炭酸カルシウム
・石灰水に二酸化炭素を吹き込むとできる白色の塩。同時に白い沈殿もできる。 | |
|
| 練習問題 |
| ■ハロ理科の目次 ■Top |
| 商用目的での利用を固く禁じます。 |