| ■ Hello
School 中学理科(ハロ理科) No.5 物質の性質 ■ |
| インターネット上で中学校の理科が勉強できるよ♪ |
| ノートに理解しながら写して、一通り終えたら練習問題で実力を定着させていこうね♪ |
|
| 1.物質の性質 |
| (1)有機物と無機物 |
有機物…加熱すると炭になったり、燃えて二酸化炭素を発生する物質。
砂糖・紙・ろうなど。
無機物…有機物ではない物質
食塩・ガラス・アルミニウム・水など。
|
| ※炭素や一酸化炭素は無機物 |
| |
| (2)金属と非金属 |
| 無機物はさらに金属と非金属に分かれる。 |
金属の性質
・電流が流れやすく、熱が伝わりやすい。
・紙ややすりで磨くと光る。(金属光沢)
・たたくとのびる。
非金属…無機質で金属ではない物質
食塩・ガラス・水など |
| |
| (3)物質の密度 |
密度…物質1cm3あたりの質量。単位はg/cm3。
水の密度よりも小さい密度の物質→水に浮く。
水の密度よりも大きい密度の物質→水に沈む。 |
| |
|
|
|
| 物質 |
金 |
鉛 |
水銀 |
銅 |
鉄 |
アルミニウム |
硫酸 |
海水 |
水 |
氷 |
エタノール |
二酸化炭素 |
酸素 |
空気 |
水蒸気 |
水素 |
| 密度 |
19.3 |
11.34 |
13.55 |
8.93 |
7.86 |
2.69 |
1.83 |
1.01 |
1.00 |
0.92 |
0/79 |
0.00184 |
0.00133 |
0.00120 |
0.0006 |
0.00008 |
| 状態 |
固体 |
固体 |
液体 |
固体 |
固体 |
固体 |
液体 |
液体 |
液体 |
液体 |
液体 |
気体 |
気体 |
気体 |
気体 |
気体 | | |
|
| 2.物質の状態変化 |
| (1)物質の状態 |
物質の3態…固体・液体・気体の状態のこと。
固体…形や体積が決まっている。→鉄・石・木など。
液体…形は決まっていないが体積が決まっている。→水・アルコールなど。
気体…形も体積も決まっていない。→酸素・水素・二酸化炭素など。
物質の状態変化…物質を熱したり、冷やしたりしたときに物質の状態が変わること。
熱したとき…固体→液体→気体 冷やしたとき…気体→液体→固体 |
| |
| (2)水の状態変化 |
熱したとき
氷→水→水蒸気
冷やしたとき
水蒸気→水→氷
|
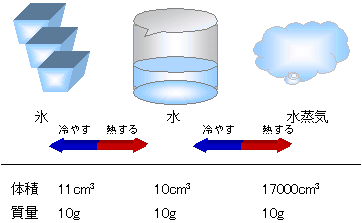 |
※ゆげは水蒸気ではなく、
水蒸気が冷えて細かい
水滴になったもの。
水蒸気は目に見えない。 | | |
|
| 3.状態変化と体積・質量 |
| (1)状態変化と体積・質量 |
・液体⇔気体の場合
右の図のように、試験管に水を入れて熱すると、
ポリエチレンの袋がふくらむ。
↓
水蒸気の体積がもとの水の体積の約1700倍になった。
逆に冷やすとポリエチレンの袋はしぼむ。
↓
|
 |
| |
|
| 物質1gの体積 |
|
| 物質 |
水 |
エタノール |
エーテル |
アセトン |
| 液体[cm3] |
1.00 |
1.267 |
1.391 |
1.264 |
| 気体[cm3] |
1701 |
625 |
341 |
465 |
| およその倍率 |
1700 |
490 |
250 |
370 | | |
| |
|
・液体⇔固体の場合
水を冷やして氷にすると、質量は変わらないが、体積が1.1倍になる。 |
| |
状態変化と体積・質量
体積は変化するが、質量は変わらない。 | | |
|
| 4.融点 |
| (1)融解と凝固 |
融解…固体の状態の物質が熱せられて、液体の状態になること。
そのときの温度を融点という。
凝固…液体の状態の物質が冷やされて、固体の状態になること。
そのときの温度を凝固点という。(融点と凝固点は同じ値) |
| |
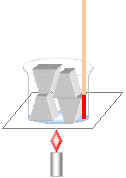
| (2)純粋な物質の融点 |
・氷の融点
右の図のように、ビーカーに氷を10gと20gを
別々に入れて、加熱していく。
↓
①0℃まで温度が上がっていく。
↓
②0℃になると氷が融解し始める。
氷がすべて水になるまで0℃のまま。
<0度が氷の融点>
↓
③すべて水になった後は再び温度が上がる。
↓
④氷が10gでも20gでも同じ状態。
<融点は量の多少に関わりなく一定>
(量が多くなると融解している時間が長く、
グラフの傾きが緩やかになる。) |
 |
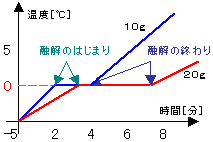 |
| 物質を加熱したとき、縦軸に温度、横軸に過熱時間をとったときにできるグラフを加熱曲線という。 |
| |
|
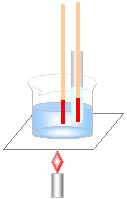
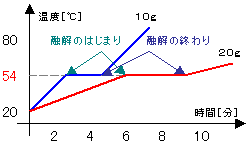
・パラジクロロベンゼンの融点
右の図のように、ビーカーにパラジクロロベンゼン
を10gと20gを別々に入れて、加熱していく。
↓
①約54℃まで温度が上がっていく。
<固体の状態>
↓
②約54℃になると融解し始める。
融解が終わるまで約54℃のまま。
(グラフが平行)
<固体と液体が混ざった状態>
↓
③すべて液体になった後は再び温度が上がる。
<液体の状態>
↓
④パラジクロロベンゼンが10gでも20gでも
同じ状態。
<融点は量の多少に関わりなく一定> |
 |
 |
| |
|
純粋な物質の融点
融点は量の多少に関わりなく一定で、融解中は温度が上がらない。 |
| |
|
| (3)混合物の融点 |
|
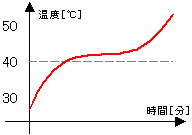
右のグラフは、ナフタレンとパラジクロロベンゼン
の混合物を加熱していったときのグラフである。
↓
グラフに水平な部分が現れない。
|
 | | |
|
| 5.沸点 |
| (1)蒸発と沸騰 |
気化…液体の状態の物質が気体の状態になること。
蒸発…液体の表面だけで、液体が気化すること。
沸騰…気体の内部からも液体が気化すること。
そのときの温度を沸点という。 |
| |
|
| (2)純粋な物質の沸点 |
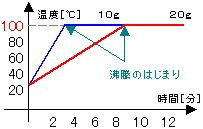
・水の沸点
右の図のように、フラスコに水を10gと20gを
別々に入れて、加熱していく。
↓
①100℃まで温度が上がっていく。
↓
②100℃になると水が沸騰し始める。
沸騰が終わるまで100℃のまま。
<100度が氷の融点>
↓
③水が10gでも20gでも同じ状態。
<沸点は量の多少に関わりなく一定> |
 |
 |
| |
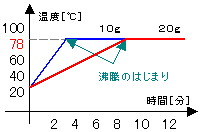
・エタノールの沸点
右の図のように、フラスコにエタノールを
10gと20gを別々に入れて、水を入れたビーカー
の中に入れながら、を加熱していく。
(エタノールは引火しやすく、直接加熱は危険)
↓
①78℃まで温度が上がっていく。
<液体の状態>
↓
②78℃になると沸騰し始める。
沸騰が終わるまで78℃のまま。
(グラフが平行)
<液体と気体が混ざった状態>
↓
③しばらくすると沸騰が終わる。
<気体の状態>
↓
④エタノールが10gでも20gでも同じ状態。
<沸点は量の多少に関わりなく一定> |
 |
 |
| |
|
純粋な物質の沸点
沸点は量の多少に関わりなく一定で、沸騰中は温度が上がらない。 |
| |
|
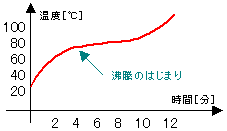
| (3)混合物の沸点 |
|
右のグラフは、水とエタノールの混合物を
加熱していったときのグラフである。
↓
グラフに水平な部分が現れない。 |
 |
| |
|
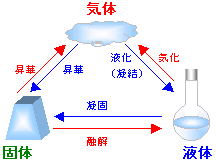
| (4)物質の状態変化と融点・沸点 |
|
昇華…固体の状態から気体の状態になったり、
気体の状態から固体の状態になること。
(ナフタレン・ヨウ素・パラジクロロべンゼン
・ドライアイスなど)
液化(凝結)…気体の状態から液体の状態に
なること。
(寒い冬の日に息を吐くと(気体)、
吐く息が白い水滴(液体)として
出てくる) |
 |
| |
|
| 物質の融点・沸点データ(クリック) | |
|
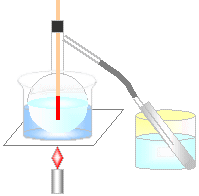
| 6.蒸留 |
| (1)蒸留 |
|
蒸留…液体を加熱し、沸騰して出てきた気体を冷やして液体
にすること。
右の図で、フラスコの中に
食塩水を入れた場合、
試験管の中に純粋な水(蒸留水)が得られる。
水とエタノールの混合溶液を入れた場合、
76℃~82℃で気体を集めると、試験管の中にエタノール
が中心に集まる。
98℃~100℃で気体を集めると、試験管の中に水
が中心に集まる。 |
 | |
|
| 練習問題 |
| ■ハロ理科の目次 ■Top |
| 商用目的での利用を固く禁じます。 |